歐盟GMP檢查:從查詢途徑到(arrive)檢查趨勢分析
2023-10-10 10:14:00在(exist)這(this)篇文章中,我(I)們(them)将一(one)一(one)探讨這(this)些問題,幫助您更好地(land)了(Got it)解歐盟的(of)GMP檢查現狀。
EudraGMDP介紹
-
生(born)産和(and)進口許可(Manufacturing and import authorisations) -
GMP證書(Good Manufacturing Practice (GMP) certificates.) -
GMP不(No)符合性聲明(Statements of non-compliance with GMP) -
第三國的(of)GMP檢查計劃(GMP inspection planning in third countries) -
批發分銷許可(Wholesale Distribution Authorisations) -
GDP證書(Good Distribution Certificates (GDP)) -
GDP不(No)符合性聲明(Statements of non-compliance with GDP) -
EEA人(people)用(use)活性物質制造商、進口商和(and)分銷商注冊(Registration of manufacturers, importers and distributors of active substances for human use located in the EEA)
下面我(I)們(them)将重點介紹一(one)下GMP certificates和(and)Statements of non-compliance with GMP。
GMP證書和(and)GMP不(No)符合性聲明



Part 2:與本NCS相關的(of)制造商的(of)活動;
根據本次檢查的(of)範圍,選擇模塊中對應内容,針對人(people)用(use)藥品、獸用(use)藥品、臨床試驗用(use)藥三個(indivual)部分,包括的(of)模塊有:無菌産品、非無菌産品、生(born)物制品、包裝、質量控制等,對于(At)進口藥品也有進口質量控制檢測和(and)批放行(Batch certification of imported medicinal products)等對應選項,如沒有列舉的(of)内容,需要(want)在(exist)“Other”中補充。

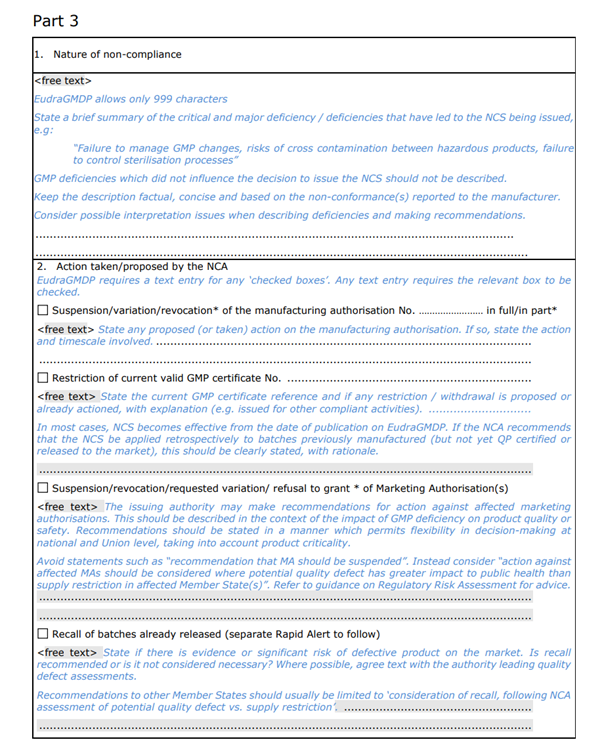
Part 3:不(No)符合項目的(of)說明及官方所要(want)采取的(of)措施;
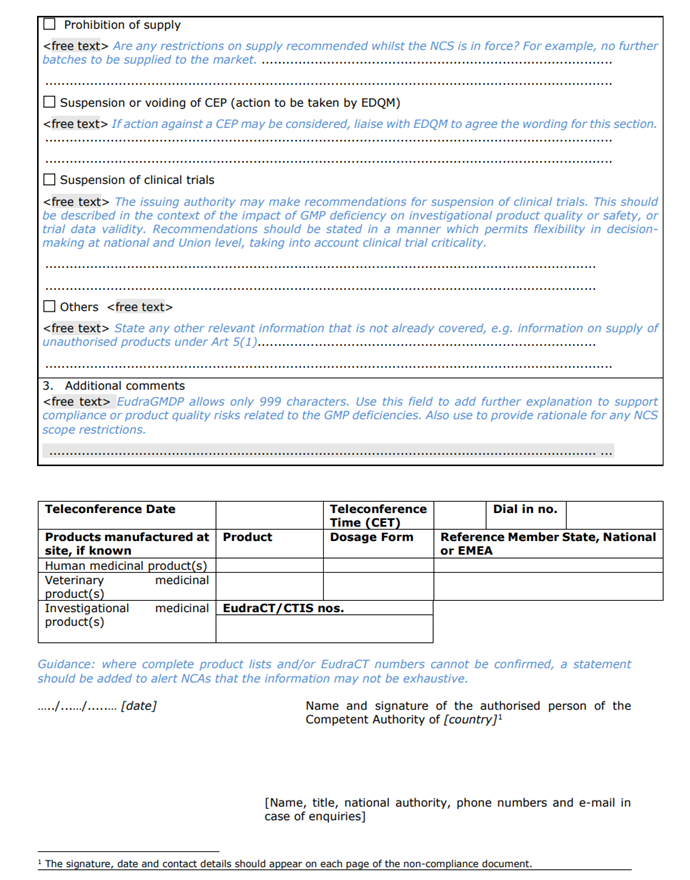
聲明中僅概括了(Got it)導緻本次NCS的(of)關鍵(critical)和(and)主要(want)(major)缺陷,包括缺陷的(of)數量及簡單描述,并未詳細的(of)描述具體如何違反GMP。NCA(National Competent Authorities)已采取或建議采取的(of)行動,包括撤銷/變更/暫停生(born)産許可、GMP證書、上市許可,中止CEP證書,中止臨床試驗等情況。
通過歐盟GMP檢查企業的(of)缺陷項并未包括在(exist)EudraGMDP中,官方會不(No)定期的(of)發布和(and)總結,例如EDQM在(exist)2019發布的(of)2006~2018檢查和(and)缺陷趨勢概況文件(EDQM inspections and trends of deficiencies Overview 2006 to 2018),這(this)份文件中就包括2006~2018年API檢查及缺陷分析,大(big)家可以(by)在(exist)網上自行查詢。
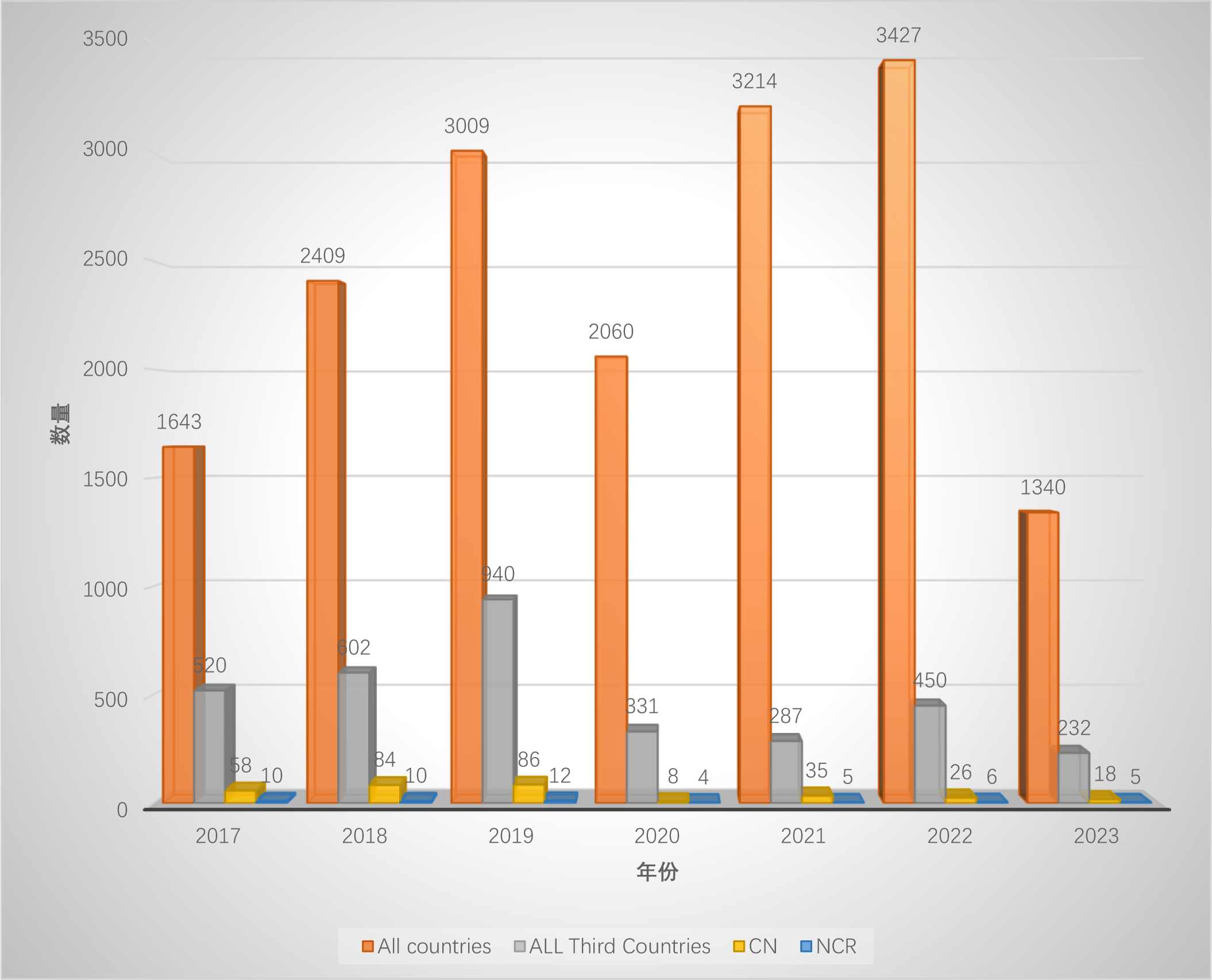
2017~2023年EU GMP檢查數據分析
制作(do)了(Got it)兩份圖表來(Come)對比,圖一(one)爲(for)不(No)同年份及對應的(of)檢查數量,圖二是(yes)不(No)同年份第三國檢查數量、中國檢查數量以(by)及發布的(of)不(No)符合聲明數量的(of)占比。
如果我(I)們(them)假設檢查官都會在(exist)檢查完成後90天才登記在(exist)數據庫中,那麽2023年的(of)數據剛好是(yes)6個(indivual)月,可以(by)代表2023年一(one)半的(of)檢查量。
-
考慮到(arrive)2020年的(of)特殊情況,2017年至2022年,總的(of)檢查數量逐年攀升,但2023年卻熄火了(Got it),這(this)是(yes)爲(for)什麽? -
2020年以(by)來(Come),雖然開啓了(Got it)遠程檢查的(of)模式,但是(yes)歐盟在(exist)第三國的(of)檢查總量遠低于(At)2017~2019年;原因可能是(yes):新冠期間歐盟發布了(Got it)“QUESTIONS AND ANSWERS ON REGULATORY EXPECTATIONS FOR MEDICINAL PRODUCTS FOR HUMAN USE DURING THE COVID-19 PANDEMIC”,其中描述了(Got it)在(exist)EEA以(by)外生(born)産的(of)API和(and)制劑的(of)GMP證書有效期延長至2022年底,後續又在(exist)EMA官網上寫到(arrive)延長至了(Got it)2023年底。 -
我(I)們(them)都以(by)爲(for)2023年歐盟在(exist)包括中國在(exist)内的(of)第三國的(of)檢查數量會暴增,結果卻并沒有。如果考慮是(yes)因爲(for)在(exist)EEA以(by)外生(born)産的(of)API和(and)制劑的(of)GMP證書有效期延長至2023年底,那麽2023年在(exist)中國以(by)及第三國的(of)檢查數量将與2022年相近,或可做解釋。
仁者見仁,各位看官對這(this)些數據有何看法?
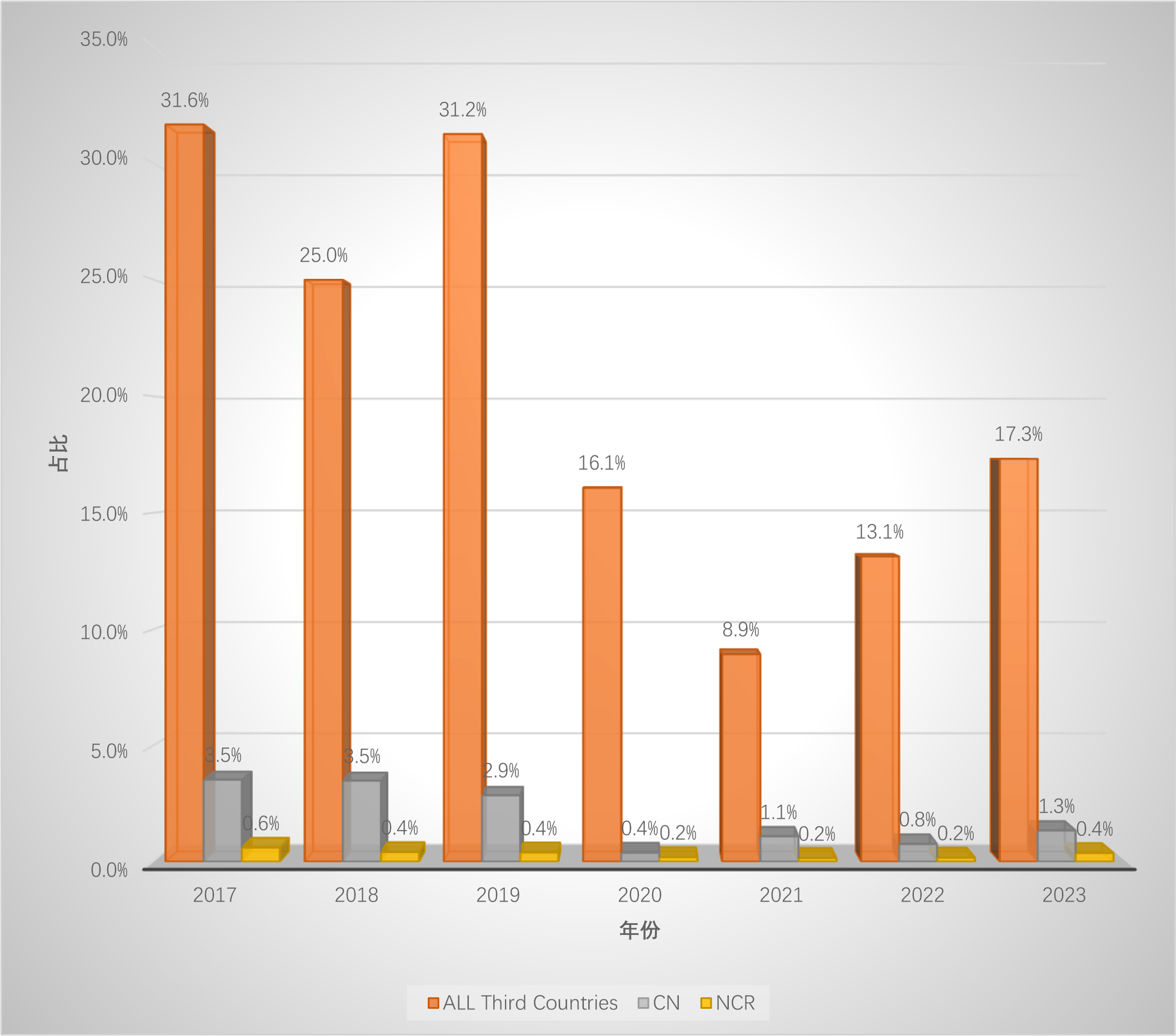
-
EU GMP差距分析
-
質量體系提升
-
專題培訓
-
模拟審計
-
迎檢準備
-
現場陪檢及翻譯
-
缺陷關閉指導
在(exist)下一(one)期的(of)文章中,我(I)們(them)計劃讨論歐盟近年來(Come)發布的(of)GMP不(No)符合性聲明,研究了(Got it)解這(this)些聲明中究竟涉及了(Got it)哪些缺陷,以(by)及是(yes)什麽原因導緻了(Got it)檢查未通過。我(I)們(them)歡迎各位繼續關注,共同學習,共同進步。
策劃:魏巍
編寫:王亞蕊










